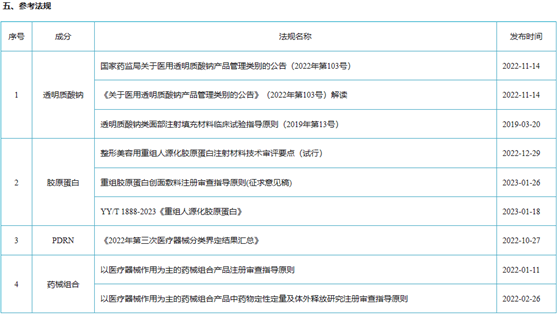
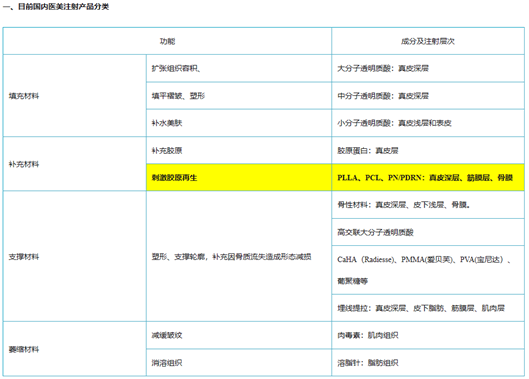
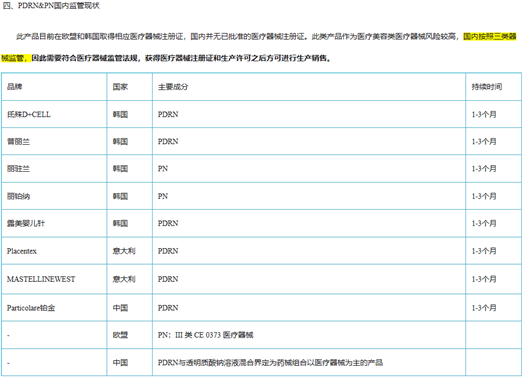
2022年10月27日,国家药品监督管理局医疗器械标准管理中心(NIFDC)对外发布《2022年第三次医疗器械分类界定结果汇总》在此次界定结果汇总中最值得关注的是,“注射用透明质酸钠复合溶液”成分为透明质酸钠和多聚脱氧核糖核苷酸(PDRN)复合溶液,用于注射至面部真皮层,从而改善皮肤状态,为一次性使用无菌产品,被界定成以医疗器械为主的药械组合产品。
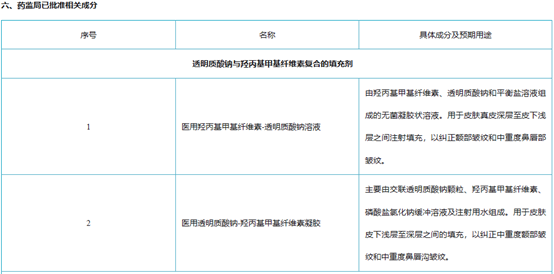
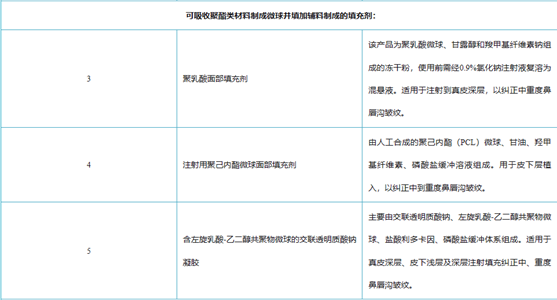
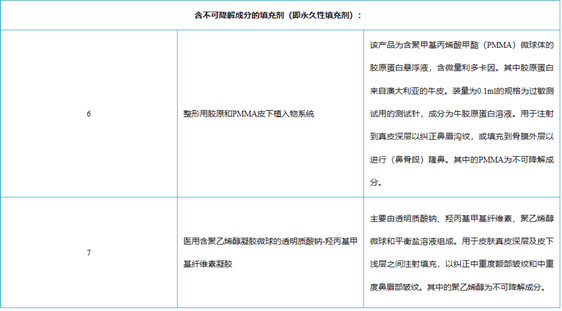
目前在国内最受欢迎的三个再生材料为PLLA(童颜针)、PCL(少女针)\ PN/PDRN(婴儿针)。PDRN多聚脱氧核糖核苷酸(Polydeoxyribonudeotide),是一种可靠的细胞生长活性物质,是脱氧核糖核酸混合物,天然大分子多核苷酸(PN)也逐步用于医美类产品,与PLLA/PLC相比,PDRN/PN的抗衰效果更好,注射部位更广。
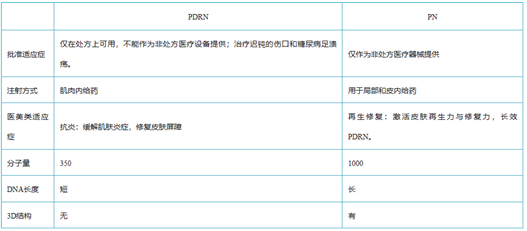
PDRN与PN二者都是从三文鱼精囊细胞中提取优化的DNA片段,与人体DNA极为相似。具有刺激胶原蛋白和弹力纤维再生的功能,能有效缓解炎症的功能,在人体皮肤、韧带和肌腱的再生修复方面效果显著。PDRN最早用于医美是意大利Mastelli的婴儿针,侧重于抗炎修复。PN是天然大分子物质,适用于填充再生抗衰。
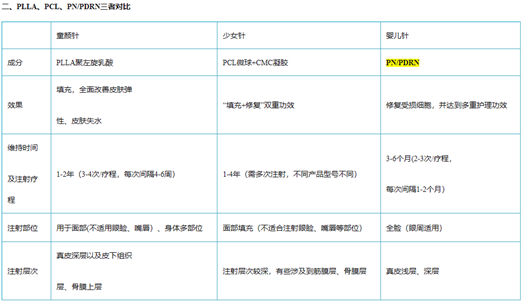
三、PDRN和PN的对比
(1)三类医疗器械注册流程
依据《医疗器械监督管理条例》规定,第II、III类医疗器械施行注册管理,在投放中国市场前,应先向药品监督管理部门提交注册申请并获得医疗器械注册证。同时确保在医疗器械生产质量管理规范体系下开展研发及生产经营活动。
(2)三类医疗器械临床试验
临床试验是医疗器械临床评价过程中临床数据的主要来源,是为评价医疗器械安全性、临床性能或有效性而开展的系统性试验或研究,包括可行性试验、注册临床试验及上市后临床试验。医疗器械临床试验应符合《医疗器械临床试验质量管理规范》(也称为医疗器械GCP)要求,并在中国备案的医疗器械临床研究机构开展。